Để giúp các em ôn thi giữa kì 1 môn Hóa 11 tốt nhất, VUIHOC đã tổng hợp các kiến thức cần nắm vững, các dạng bài tập có thể xuất hiện trong đề thi. Mời các em cùng tham khảo bài viết và chia sẻ cho bạn bè của mình cùng tham khảo nhé!
1. Đề cương ôn thi giữa kì 1 môn Hóa 11 chương cân bằng hóa học
1.1 Khái niệm cân bằng hóa học
- Phản ứng một chiều là phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng với nhau tạo thành chất ban đầu.
- Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều trái ngược nhau trong cùng điều kiện. Trong phản ứng thuận nghịch đồng thời xảy ra sự chuyển chất phản ứng thành chất sản phẩm và ngược lại.
- Cân bằng hóa học là trạng thái của phản ứng thuận nghịch, trong đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch. Một phản ứng thuận nghịch bất kì tại trạng thái cân bằng sẽ có hằng số cân bằng được tính bằng biểu thức:
- Hằng số cân bằng chỉ phụ thuộc vào nhiệt độ, áp suất và bản chất của phản ứng, không phụ thuộc vào nồng độ ban đầu của các chất.
- Nguyên lí dịch chuyển cân bằng Le Chatelier: Một phản ứng thuận nghịch ở trạng thái cân bằng nếu chịu tác động từ bên ngoài của nhiệt độ, áp suất hay nồng độ thì cân bằng sẽ dịch chuyển theo chiều làm giảm tác động bên ngoài đó.
1.2 Cân bằng trong dung dịch nước
a. Sự điện li
- Sự điện li là quá trình phân li các chất trong nước và tạo thành các ion. Chất điện li là chất khi tan trong nước phân li thành các ion, ngược lại chất tan trong nước không phân li thành các ion là chất không điện li.
- Các chất tan trong nước phân li hoàn toàn thành các ion là chất điện li mạnh, một số chất điện li mạnh là:
+ Một số các acid mạnh: HCl, HNO3, H2SO4, …
+ Một số các base mạnh: NaOH, KOH, Ca(OH)2, Ba(OH)2 …
+ Hầu hết muối đều là chất điện li mạnh.
- Các chất điện li yếu: CH3COOH, HClO, HF, H2CO3 … (acid), Cu(OH)2, Fe(OH)2 …(base)
b. Thuyết Bronsted – Lowry: Acid là chất cho proton và base là chất nhận proton. Acid và base có thể là phân tử hoặc ion.
- Acid mạnh và base mạnh phân li hoàn toàn trong nước, acid yếu và base yếu phân li một phần trong nước. Các ion tác dụng với nước tạo thành H+ là acid, còn tạo thành OH- là base.
c. Độ pH
pH là một chỉ số dùng để đánh giá độ acid hay độ base của một dung dịch với cách tính theo quy ước như sau:
pH = -log[H+] hoặc [H+] = 10-pH
Trong đó [H+] là nồng độ mol của ion H+. Nếu dung dịch có [H+] = 10-a thì pH = a.
- Môi trường có tính acid có độ pH < 7, có tính base pH > 7, trung tính pH = 7.
- Xác định chỉ sô pH thông qua chất chỉ thị có màu sắc biến đổi phụ thuộc vào giá trị pH của dung dịch. Các chất chỉ thị thường gặp là giấy quỳ, giấy pH, phenolphthalein...
- Các phản ứng hóa học trong thực tiễn xảy ra ở một khoảng pH xác định.
d. Phản ứng thủy phân: Là phản ứng của ion với nước.
e. Chuẩn độ: Là phương pháp giúp xác định nồng độ của một chất bằng dung dịch chuẩn đã biết nồng độ.
2. Đề cương ôn thi giữa kì 1 môn Hóa 11 chương nitrogen và sulfur
1.1 Nitrogen
- Nitrogen là nguyên tố tồn tại trong tự nhiên ở cả dạng đơn chất và hợp chất. Dạng đơn chất có trong khí quyển, chiếm 75,5% khối lượng, tập trung ở tầng đối lưu. Dạng hợp chất tồn tai trong vỏ Trái Đất dưới dạng khoáng vật của Sodium Nitrate.
- Cấu tạo phân tử nitrogen: Phân tử nitrogen được cấu tạo gồm hai nguyên tử liên kết với nhau bằng liên kết ba (1 liên kết σ và 2 liên kết π). Phân tử nitrogen có năng lượng liên kết lớn (945kJ/mol) và không có cực.
- Tính chất vật lý của nitrogen: Là chất khí, không màu, không mùi, tan ít trong nước, khó hóa lỏng, không duy trì hô hấp và sự cháy.
- Tính chất hóa học: Nitrogen là một khí khá trơ ở nhiệt độ thường, ở nhiệt độ cao, nitrogen trở nên hoạt động tốt hơn. Nitrogen có khả năng thể hiện cả tính oxi hoá và tính khử.
+ Tác dụng với hydrogen: N2(g)+3H2(g) ⇆ 2NH3(g)
+ Tác dụng với oxygen: N2(g)+O2(g) ⇆ 2NO(g)
△r = 180,6kJ
- Ứng dụng của nitrogen: Nitrogen có ứng dụng trong y tế, công nghệ thực phẩm, sản xuất hóa chất...
- Điều chế nitrogen: NH4NO2 => N2 + 2H2O hoặc NH4Cl + NaCl => N2 + NaCl + 2H2O
1.2 Hợp chất của nitrogen Ammonia, muối ammonium
a. Hợp chất của nitrogen: Ammonia
- Cấu tạo phân tử: Có dạng chóp tam giác, phân tử chứa 3 liên kết N-H phân cực và một cặp electron không liên kết trên nguyên tử nitrogen
- Ammonia có mùi khai, dễ tan trong nước, dễ hóa lỏng
- Ammonia có tính base và tính khử
+ Tính base của Ammonia:
NH3 + HCl => NH4Cl
NH3 + HNO3 => NH4NO3
2NH3+H2SO4 => (NH4)2SO4
+ Tính khử của Ammonia:
- Sản xuất Ammonia: N2(g) + 3H2(g) ⇌ 2NH3(g)
b. Hợp chất của nitrogen: muối ammonium
- Tính tan, sự điện li: Muối ammonium có tan trong nước và phân li thành ion
NH4Cl => NH4+ + Cl-
- Tác dung với kiềm:
- Muối ammonium kém bền với nhiệt độ:
- Ứng dụng của muối ammonium: Y tế, phân bón hóa học, phụ gia thực phẩm…
1.3 Hợp chất của nitrogen với oxygen
- Oxide của nitrogen sẽ được kí hiệu chung dưới dạng là NOx, đây là một loại hợp chất rất điển hình gây nên tình trạng ô nhiễm không khí. Hợp chất NOx có trong không khí là N2O, NO, NO2, N2O4.
- Hiện tương mưa axit:
- Hợp chất của nitrogen với oxygen: Nitric acid là acid mạnh, có tính oxi hóa mạnh
1.4 Sulfur và sulfur dioxide
a. Sulfur (lưu huỳnh)
- Sulfur tồn tại trong tự nhiên ở cả 2 dạng là dạng đơn chất và dạng hợp chất. Đơn chất sulfur được tìm thấy phân bố chủ yếu ở những vùng lân cận núi lửa và các suối nước nóng tự nhiên,... Hợp chất sulfur gồm các khoáng vật như sulfide, sulfate, protein...
- Cấu tạo phân tử sulfur bao gồm 8 nguyên tử (S8) có dạng vòng khép kín. Mỗi nguyên tử sulfur sẽ liên kết với hai nguyên tử khác ở bên cạnh bằng hai liên kết cộng hoá trị không có tính phân cực.
- Tính chất vật lí: Sulfur không tan trong nước, ít tan trong ancol, tan nhiều trong carbon disulfide, nhiệt độ nóng chảy là 113°C và sôi 445 °C.
- Tính chất hóa học:
+ Tác dụng với hydrogen:
+ Tác dụng với kim loại:
+ Tác dụng với phi kim:
b. Sulfur dioxide
- Tính chất vật lý: Là chất không màu, nặng hơn không khí, có mùi hắc, tan nhiều trong nước. Sulfur dioxide là khí độc, nếu hít nhiều sẽ gây ra viêm đường hô hấp.
- Tính chất hóa học:
+ Tính oxi hóa
+ Tính khử:
Ứng dụng: Là chất trung gian quan trọng sản xuất sulfuric acid, tẩy trắng bột giấy, khử màu sản xuất đường, chống nấm mốc cho sản phẩm mây tre đan.
1.5 Sulfuric acid và muối sulfate
a. Sulfuric acid
- Cấu tạo: Phân tử sulfuric acid (H2SO4) có công thức cấu tạo như hình dưới đây:
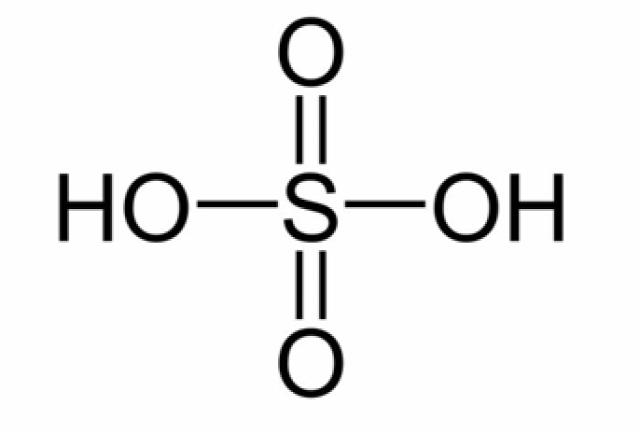
- Tính chất vật lý: Là chất lỏng sánh, không màu, không bay hơi, hút ẩm mạnh, có thể tan vô hạn trong nước và tỏa nhiệt nhiều.
- Tính chất hóa học:
+ Tính axit
+ Tính oxi hóa:
+ Tính háo nước ( hiện tượng than hóa)
- Ứng dụng: Sản xuất thuốc nhuộm, chất tẩy rửa, phân bón...
- Sản xuất: sulfuric acid chủ yếu được sản xuất bằng phương pháp tiếp xúc đi từ nguyên liệu chính là sulfur, quặng pyrite (chứa FeS2)
b. Muối sulfate
Một số muối sulfate quen thuộc với chúng ta và ứng dụng của chúng trong cuộc sống:
- Ammonium sulfate có vai trò trong sản xuất phân đạm.
- Calcium sulfate có ứng dụng trong sản xuất thạch cao.
- Magnesium sulfate dùng trong sản xuất khoáng chất bổ sung cho phân bón, thức ăn của gia súc.
- Barium sulfate ứng dụng trong sản xuất chất cản quang trong chẩn đoán hình ảnh y tế.
3. Ôn thi giữa kì 1 môn Hóa 11: Luyện tập
Câu 1: Một hệ hóa học ở trạng thái cân bằng thì phát biểu nào dưới đây đúng?
A. Phản ứng nghịch đã dừng
B. Phản ứng thuận đã dừng
C. Nồng độ các chất trong hệ không thay đổi
D. Nồng độ các chất tham gia và sản phẩm bằng nhau.
Đáp án C: Khi phản ứng đạt trạng thái cân bằng thì nồng độ các chất trong hệ không thay đổi.
Câu 2: Hằng số cân bằng của phản ứng chỉ phụ thuộc vào yếu tố nào?
A. Áp suất
B. Nồng độ
C. Nhiệt độ
D. Chất xúc tác
Đáp án C: Kc phụ thuộc vào nhiệt độ
Câu 3: Trong phản ứng cân bằng, nếu thêm vào chất xúc tác thì:
A. Tốc độ phản ứng thuận tăng lên
B. Tốc độ phản ứng nghịch tăng lên
C. Tốc độ phản ứng thuận nghịch không tăng lên
D. Tốc độ phản ứng thuận và nghịch tăng lên như nhau
Đáp án D: Chất xúc tác không làm thay đổi cân bằng hóa học, chỉ đẩy nhanh tốc độ phản ứng thuận nghịch.
Câu 4: Cho phản ứng cân bằng N2 + 3H2 ⇄ 2NH3. Yếu tố nào sau đây không làm chuyển dịch cân bằng?
A. Tăng nồng độ H2
B. Thêm chất xúc tác
C. Tăng nhiệt độ
D. Giảm nồng độ NH3
Câu 5: Có thể thu được nguyên tố nitrogen từ phản ứng nào ở dưới đây?
A. Đem đun nóng dung dịch bão hòa sodium nitrite cùng với Ammonium Chloride.
B. Đưa muối Silver nitrate đi nhiệt phân.
C. Cho bột Cu vào phản ứng dung dịch HNO3 đặc, nóng.
D. Cho muối Ammonium nitrate vào một dung dịch kiềm.
Đáp án A: Đem đun nóng dung dịch bão hòa sodium nitrite cùng với Ammonium Chloride.
Câu 6: Trong các chất dưới đây, chất nào có thể tác dụng được với N2 ở nhiệt độ thường?
A. Mg.
B. O2.
C. Na.
D. Li.
Đáp án D: Li
Câu 7 Trong dung dịch Amoniac là một base yếu vì?
A. Amoniac tan nhiều trong nước
B. Phân tử amoniac là phân tử có cực
C. Khi hòa tan trong nước, Amoniac kết hợp với nước tạo thành ion NH4+ và OH-
D. Khi tan trong nước, một phần nhỏ các phân tử amoniac kết hợp với ion H+ của nước tạo ra NH4+ và OH-
Đáp án: D: Khi tan trong nước, một phần nhỏ các phân tử amoniac kết hợp với ion H+ của nước tạo ra NH4+ và OH-
Câu 8: Cách pha loãng H2SO4 đặc an toàn là:
A. rót từ từ axit vào nước và khuấy đều
B. rót nhanh axit vào nước và khuấy đều
C. rót từ từ nước vào axit và khuấy đều
D. rót nhanh nước vào axit và khuấy đều
Đáp án A: rót từ từ axit vào nước và khuấy đều bằng đũa thủy tinh, tuyệt đối không làm ngược lại.
Câu 9. Trung hòa 100ml dung dịch H3PO4 1,5M cần phải dùng Vml dung dịch hợp chất KOH 2M. Hãy tính giá trị của V:
A. 75 ml.
B. 300 ml.
C. 225 ml.
D. 150 ml.
Đáp án C: 225ml
Câu 10. Cho phản ứng hóa học NH3 + HCl → NH4Cl. Hãy cho biết vai trò của amoniac trong phản ứng này là gì?
A. Bazơ.
B. Axit.
C. Chất oxi hóa.
D. Chất khử.
Đáp án A: Bazơ
Câu 11. Hãy cho biết hợp chất amoni là chất điện li thuộc loại nào?
A. Yếu.
B. Mạnh.
C. Không xác định được.
D. Trung bình.
Đáp án B: Amoni là chất điện li mạnh
Câu 12. Cho 39 gam chất kim loại M phản ứng hoàn toàn với dung dịch HNO3, sản phẩm thu được là 8,96 lit khí NO (là sản phẩm khử duy nhất ở đktc). Hãy cho biết kim loại M là kim loại gì?
A. Zn.
B. Ca.
C. Cu.
D. Mg.
Đáp án A: Zn
Câu 13. Hãy cho biết sấm sét trong khí quyển có thể tạo ra được chất khí nào trong các khí dưới đây?
A. N2.
B. NO.
C. N2O.
D. CO.
Đáp án B: NO
Câu 14. Hãy cho biết phẩm khi cho photpho tác dụng với oxi dư là
A. P2O3.
B. P2O5.
C. P5O2.
D. PO5.
Đáp án B: P2O5
Câu 15. Cho 0,3 mol axit H3PO4 tác dụng với dd có chứa 0,4 mol NaOH. Muối tạo ra sau khi phản ứng là
A. NaH2PO4, NaOH dư.
B. Na2HPO4, Na3PO4.
C. NaH2PO4, Na2HPO4.
D. NaH2PO4, Na3PO4.
Đáp án C: NaH2PO4, Na2HPO4
Trên đây là toàn bộ kiến thức cần ghi nhớ trong quá trình ôn thi giữa kì 1 môn Hóa 11 mà VUIHOC đã tổng hợp lại cho các em. Bên cạnh đó, vuihoc cũng đã liệt kê những dạng bài thường gặp trong đề thi để các em có định hướng ôn tập tốt hơn. Chúc các em hoàn thành tốt bài thi giữa kì môn hóa cũng như những môn học khác nhé. Đừng quên truy cập vuihoc.vn để cập nhật thật nhiều bài học hữu ích nhé!
Nguồn:
https://vuihoc.vn/tin/thpt-de-cuong-on-thi-giua-ki-1-mon-hoa-11-chi-tiet-2179.html


